A száraz cella a villamosenergia-termelés legegyszerűbb formája. Számos cella kombinált elem együtt alkot akkumulátort. Az ólom-sav vagy nikkel-kadmium akkumulátor a száraz cellák fejlett verziója. Ezt a cellát először Georges Leclanche francia mérnök találta fel 1866-ban. Találmányát Leclanche akkumulátornak nevezték el. De abban az időben nagyon nehéz volt, és könnyen megtört. A száraz cellának ugyanaz az elve, és ez a Leclanche akkumulátor fejlett változata, és különböző feszültségű és méretű. A cink-szén elem kereskedelmi formáját, amely a Leclanche akkumulátor módosított formája, 1881-ben találta ki a mainzi Carl Gassner. Nagy mennyiségben gyártják, és számos alkalmazásban használják, például játékokban, rádiókban, számológépekben stb.
Mi az a száraz sejt?
A száraz cella olyan eszköz, amely kémiai reakciók alapján áramot termel. Amikor a cella két elektródája zárt úton kapcsolódik össze, akkor a cella arra kényszeríti az elektronokat, hogy egyik végétől a másikig áramoljanak. Az elektronok áramlása az áram áramlását okozza a zárt körben.

Száraz sejtrétegek
Kémiai reakciók segítségével az elektronok egyik végéből a másikba áramlanak. Amikor két vagy több, helyes polaritással összekapcsolt cella, több elektron áramlik a nagy potenciál miatt. Ezt a kombinációt akkumulátornak hívják. Legalább 1,5 V és 100 V közötti feszültségtől akkumulátor használható a feszültségtartomány elérésére. Még az akkumulátor kimeneti egyenfeszültségét is különböző szintekre lehet szabályozni az olyan elektromos elektronikus átalakítókkal, mint a szaggató áramkörök.
A sejt felépítése
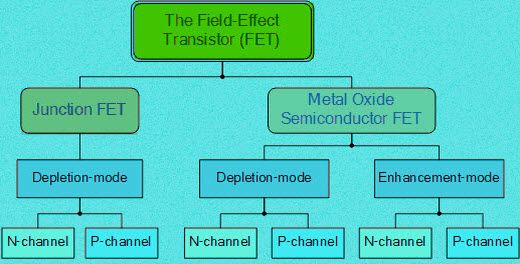
A cink-szén száraz sejt felépítését az ábra mutatja. Az anódterminál cinkként vagy általában grafit rúdként áll. A szén képezi a katód terminált. Megfigyelhető, hogy a száraz cellák régebbi verzióiban a cinket használták katódként, a grafitot pedig anódterminálként. Az elemek kiválasztása alapvetően az elemek legkülső pályájának kémiai konfigurációján alapul.

Száraz sejtszerkezet
Ha több elektronja van a legkülső pályán, akkor donorként működhet, és így képezi a katódot. Hasonlóképpen, ha a legkülső pályának kevesebb elektronja van, akkor könnyen képes elfogadni és így kialakítani az anódot. A közé helyezett elektrolit a kémiai reakciók katalizátorként működik. Általában ammónium-klorid zselét használunk elektrolitként. A bemutatott ábrán az alkalmazott elektrolit cink és klorid keveréke. A nátrium-kloridot elektrolitként is használják. Az anódrúd körül mangán-dioxid és szén keveréke van.
Az egész konfigurációt egy fémcsőbe helyezzük. A kocsonya kiszáradását megakadályozzuk a cella tetején található szurok használatával. Az aljára szénmosót helyeznek. Ennek az alátétnek az a célja, hogy megakadályozza a cink anódrúd érintkezését a tartállyal.
Ezt távtartónak is nevezik, amint azt a diagram mutatja. A cinkdobozt szigetelés céljából papírszigetelés is körülveszi. Nagyméretű akkumulátorokhoz más szigetelőanyagokat is használnak, például csillámot stb. Az ell pozitív terminálja képződik a tetején. A sejt negatív terminálja az alapon képződik.
Száraz cella működése
A száraz sejt alapvetően a kémiai reakciókon dolgozik. Az elektrolit és az elektródák között lejátszódó reakciók miatt az elektronok az egyik elektródról a másikra áramlanak. Az anyagok, például a savak vízben oldódnak, ionizált részecskéket képezve. Az ionizált részecske kétféle. A pozitív ionokat kationoknak, a negatív ionokat pedig anionoknak nevezzük. A vízben oldott savakat elektrolitoknak nevezzük.
A fent említett diagramban a cink-klorid képződik elektrolitként. Hasonlóképpen az ammónium-klorid zselé elektrolitként is képződik. Az elektrolitokba merített fémrudak elektródákat alkotnak. A fémrudak kémiai jellemzői alapján anódként pozitív elektród, katódként negatív elektród van.
Az elektródák magukra vonják az ellentétesen töltött ionokat. Például a katód vonzza az anionokat, az anód pedig a kationokat. Ebben a folyamatban az elektronok egyik irányból a másikba áramlanak, így töltések áramlását kapjuk. Ezt nevezik jelenlegi .
Kémiai reakciók
A sejtben lejátszódó reakciókat az alábbiakban mutatjuk be. Az első az oxidációs reakció.

Ebben a cinkkatódot pozitív töltésű cinkionokká oxidálják, és két ion szabadul fel. Ezeket az elektronokat az anód gyűjti össze. Ezután jön a redukciós reakció.

Az anód redukciós reakcióját a fentiekben mutatjuk be. Ez a reakció elektromos áramot eredményez. Oxidionokat szabadít fel magnézium-oxiddal. Ez a reakció akkor alakul ki, ha a magnéziumot összekapcsolják az elektrolittal.


A másik két reakció egy sav-bázis reakciót és a száraz cellában lejátszódó kicsapódási reakciót képvisel. A sav-bázis reakcióban NH-t OH-val kombinálva NH3-t kapunk vízzel együtt. Ennek eredménye az NH3 és a vízbázis.
Különbség a száraz és a nedves sejt között
A száraz és a nedves cella közötti fő különbség az elektrolit formája. Amint azt korábban említettük, egy száraz cellában az elektrolit, például az ammónium-klorid száraz természetű. Az ilyen száraz cellák gyakoribbak, és játékokban, rádiókban stb. Használják őket. De nedves cellában az elektrolit folyékony állapotban van.
Folyékony elektrolitokat, például kénsavat használnak, amely veszélyes maró folyadék. Az ilyen folyadékok jellege miatt a nedves sejt robbanékonyabb, és körültekintően kell kezelni. Az ilyen nedves cellák legjobb előnye, hogy könnyen feltölthetők és számos alkalmazáshoz felhasználhatók. Az ilyen akkumulátorok a repülésben, a közüzemi szolgáltatásokban, az energiatárolásban és a mobiltelefon-tornyokban szokásosak.
Száraz sejt funkciók
A száraz cella funkció az elektród és az elektrolitok közötti kémiai reakciók alapján. Amikor az elektródákat az elektrolitokba helyezik, az egymással ellentétesen töltött ionokat vonzza maguk felé. Ez okozza a töltések áramlását, és ezáltal áram keletkezik.
Előnyök
Az a száraz cella előnyei a következőket tartalmazzák.
- A száraz cellának számos előnye van, mint pl
- Kis méretű.
- Különböző feszültségszintekben lehet.
- Ez praktikus és számos alkalmazással rendelkezik.
- Ez az egyetlen egyenfeszültség-forrás.
- A kimeneti feszültség szabályozására elektromos áramkörökkel együtt használható
- Újratölthető.
Hátrányok
Az a száraz cella hátrányai a következőket tartalmazzák.
- Óvatosan kell kezelni
- Robbanásveszélyes
- A nagy minősítésű elemek nagyon nehezek
Alkalmazások
Az a száraz cella alkalmazásai a következőket tartalmazzák.
- Játékok
- Repülés
- Mobiltelefonok
- Rádió
- Számológép
- Órák
- Hallókészülék
Ezért láttuk a működését, osztályozását és alkalmazását száraz sejtek . Érdekes megjegyezni, hogy az akkumulátor csak akkor működik, ha az elektródák fizikailag érintkeznek egymással. A két elektróda között vezető közegnek kell lennie. A kérdés az, hogy vizet lehet-e használni vezető anyagként a száraz cella elektródái között? Ebben az esetben mi lesz, ha ezt a cellát vízbe mártják?